Dados do primeiro paciente da Fase I/IIa do experimento clínico do Hadassah Medical Organization com o produto de célula tronco, OpRegen®, utilizado para diminuir a progressão da forma avançada da degeneração macular seca relacionada à idade(dry-AMD), serão apresentados no International Symposium on Ocular Pharmacology and Therapeutics (ISOPT) em 2 de Dezembro de 2016, em Roma, Itália.
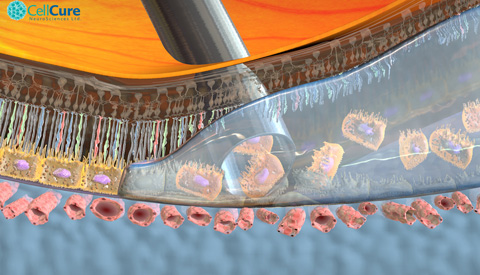
OpRegen®, composto de células de pigmento epitelial retinal (RPE) derivadas de células tronco de embrião humano, foi desenvolvido pela subsidiária da BioTime Inc, a Cell Cure Neurosciences Ltd, junto com os desenvolvedores chave Prof. Eyal Banin, Diretor do Hadassah’s Center for Retinal and Macular Degenerations e investigador líder neste experimento, e o Prof. Benjamin Reubinoff, chefe do Human Embryonic Stem Cell Research Center, do Hadassah, e Chief Scientific Officer da Cell Cure. “As células foram criadas sem o uso de produtos derivados de animais através de um processo proprietário de diferenciação direta para produzir uma população altamente purificada de células RPE,” explica o Prof. Reubinoff.
O Prof. Banin observa que o OpRegen foi “administrado com sucesso no primeiro grupo de pacientes, sem efeitos colaterais sérios.” Além disto, imagens de retina sugerem que as células RPE OpRegen são capazes de enxertar.
O estudo envolve a avaliação da segurança em três diferentes dosagens de OpRegen. O primeiro grupo de pacientes da Fase I/IIa recebeu uma dose inicial de 50.000 células. O Data Safety Monitoring Board (DSMB), um grupo independente de médicos e especialistas que monitorou de perto o experimento clínico, examinou profundamente a segurança do primeiro grupo de pacientes e recomendou que a empresa continuasse o experimento com o segundo grupo com uma dose de 200.000 células.
O recrutamento do Segundo grupo deve estar completado no final de 2016. Dependendo dos resultados da verificação da DSMB do segundo grupo, a aprovação para a administração de dose de 500.000 células ao terceiro grupo poderá ser realizada no início do próximo ano. Além disto, relata a BioTime, o primeiro experimento clínico do OpRegen nos Estados Unidos deve ser iniciado em breve.
“Nós estamos aguardando a oportunidade de apresentar dados do primeiro grupo de pacientes na ISOPT,” diz Adi Mohanty, Co-CEO da BioTime. “O progresso do OpRegen na clínica está ganhando pulso e nós temos tratado pacientes com doses de 200.000 células. É nestes grupos de doses altas de células que nós acreditamos que o OpRegen tem o potencial de demonstrar resultados clínicos mais significativos e esperamos começar a divulgar estes dados no início de 2017. Nosso objetivo é desenvolver um tratamento que possa atender a milhões de pacientes de dry-AMD para quem não há atualmente terapias aprovadas pelo FDA.”
OpRegen recebeu designação “Fast Track” da Food and Drug Administration para o tratamento da forma avançada da dry-AMD. Detalhes sobre o experimento e sobre a eligibilidade de pacientes estão disponíveis em https://clinicaltrials.gov/ com a seguinte identificação: NCT02286089 (dry-AMD).





